
大家好,这是丁香园 Insight 数据库每日晚间的药圈每日新闻时间。今天为大家带来行业内的 3 条重要新闻。
国家市场监督管理总局领导班子出炉
3 月 21 日下午 16:00,在北京市西城区三里河东路 8 号(原工商总局)C 楼十层大会议室,召开国家市场监督管理总局干部大会。国家食品药品监督管理局、国家市场监督管理总局宣布成立。
新的领导班子如下:
国家市场监督管理总局党组书记:毕井泉,原国家食品药品监督管理总局局长、党组书记;
国家市场监督管理总局局长:张茅,原国家工商行政管理总局局长;
国家 药品监督管理局局长:焦红,原国家食品药品监督管理总局副局长;
国家 药品监督管理局党组书记:李利,原江西省副省长!(via E 药经理人)
新 CDMO 公司苏桥生物正式开业
3 月 20 日,苏桥生物(CMAB)在苏州生物医药产业园正式开业。在开业仪式现场,苏桥生物与天境生物、苏州丁孚靶点、石药集团三家企业签订战略合作协议。
苏桥生物是一家初创型 CDMO(国内医药研发生产外包公司),立足于生物药物研发生产外包服务,『定制化』实现从 DNA 到成品的一站式服务体系。 2017 年 12 月,完成首轮 3800 万美元 A 轮融资,融资由康桥(C-Bridge)资本和苏州生物医药产业园(BioBAY)领投,健桥资本(I-Bridge)和前海基金联投。
根据预测,2016-2021 年我国生物制药 CDMO 市场将从 20 亿增长至 90 亿元,复合增长率将达到 35%。
君实生物 PD-1 单抗申报上市获 CDE 承办
今日,君实生物的重组人源化抗 PD-1 单克隆抗体注射液(JS001)正式获得 CDE 承办,进入新报队列。
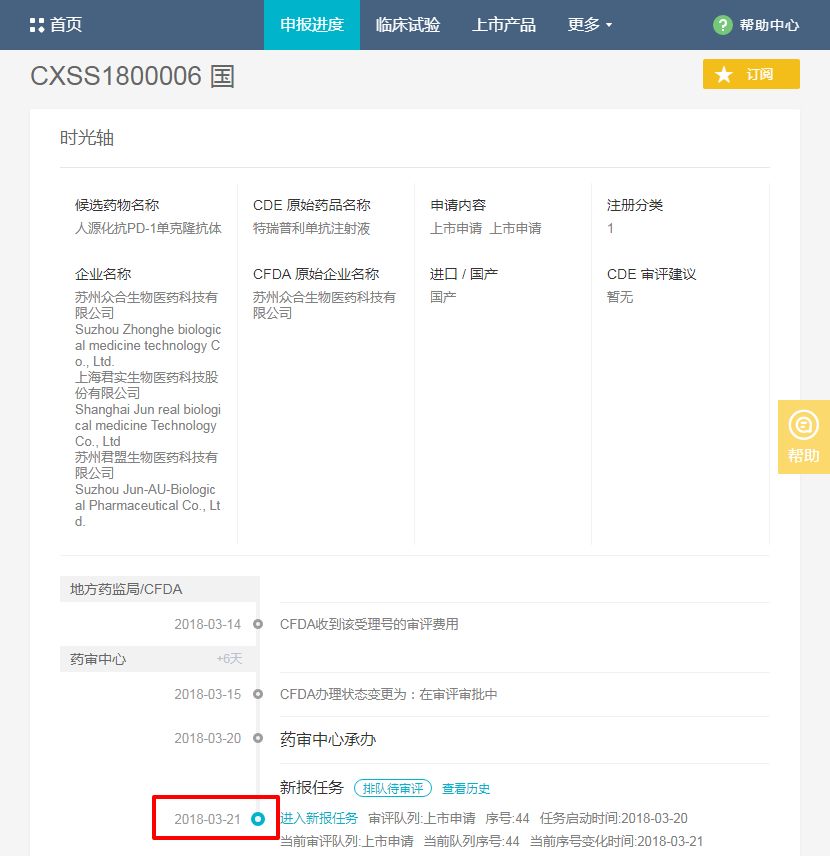
JS001(通用名称:特瑞普利单抗注射液)是国内企业首个获得 CFDA 临床试验批件的抗 PD-1 单克隆抗体注射液,目前正与国内多家临床中心开展黑色素瘤、鼻咽癌、胃癌、肺癌、食管癌、尿路上皮癌等 10 余个适应症 I~III 期临床试验。
这是继信达生物后第二个提交上市的国产 PD-1,信达生物提交的信迪单抗注射液(IBI308),于 2017 年 12 月 13 日提交上市申请,受理号为 CXSS1700038,目前处于在审批状态,在药审中心审评时长总计为 85 天。
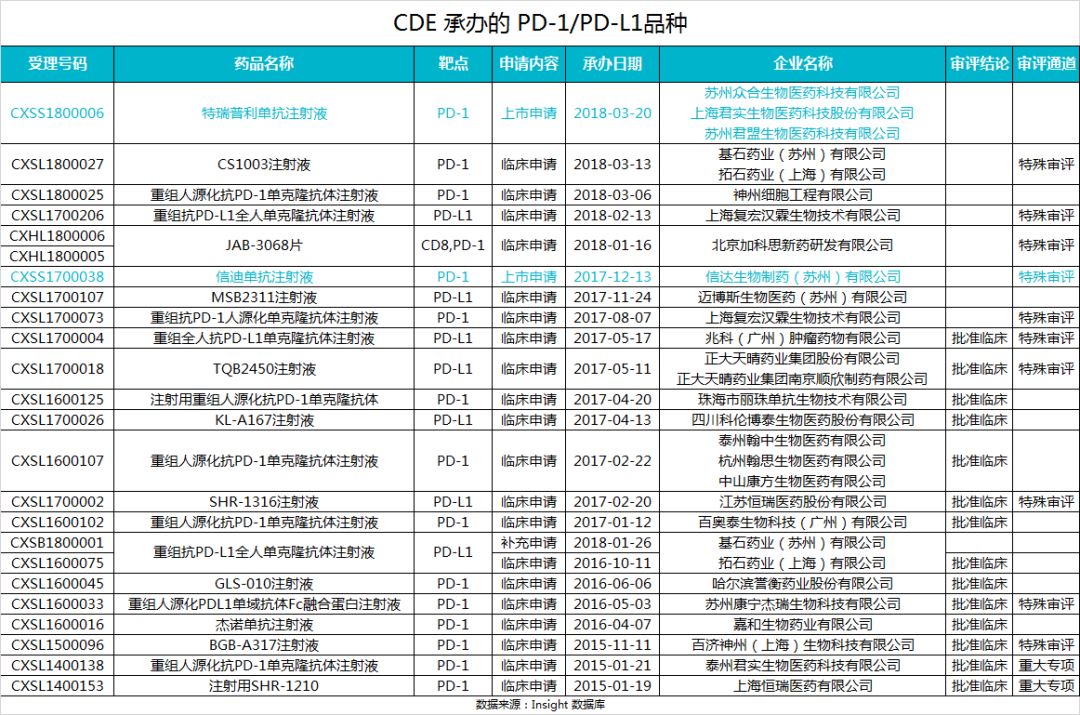
以下是目前 CDE 承办的 PD-1/PD-L1 品种:
以上资讯来源于 Insight 数据库(https://db.dxy.cn)医药新闻模块
