前言
生物类似药结构工艺复杂、研发壁垒高,而生物类似药的应用有助于提高生物技术药物可及性,因此生物类似药的开发得到各国监管机构的重视。2015年,中国食品药品监督管理总局颁布了《生物类似药研发与评价技术指导原则》,成为了中国生物类似药管理的转折点。随着国际上多个重磅生物制品的专利到期,国内企业对生物类似药的研发进展迅速。2018年中国将迎来第一个生物类似药的获批,崭新的“生物类似药时代”呼之欲出。在此大环境下,临床医生对生物类似药是怎样的观念和态度呢?他们对于生物类似药又有怎样的期待和顾虑?
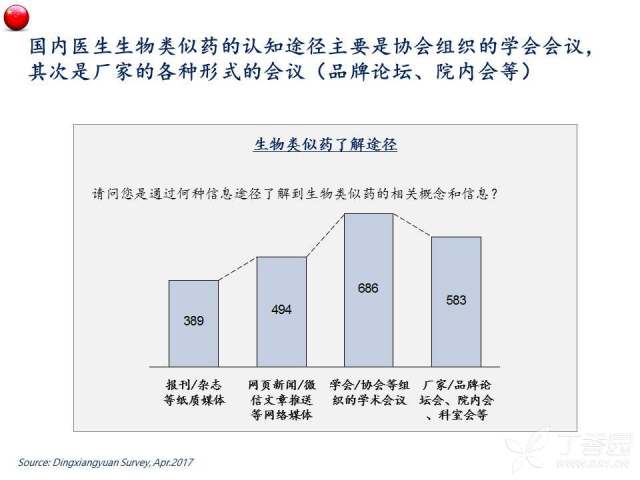
在2017年,丁香园进行了“中国生物类似药医生认知及观念调研”,旨在了解处方医生关于生物类似药热点问题的观点和看法,供各相关方面参考。
调研小结
此次调研覆盖了全国一二三线城市和多个肿瘤治疗领域的主治及以上医生,在2017年4月底回收总样本共计800余份。从调研结果来看,以下一些方面值得引起业界的关注:
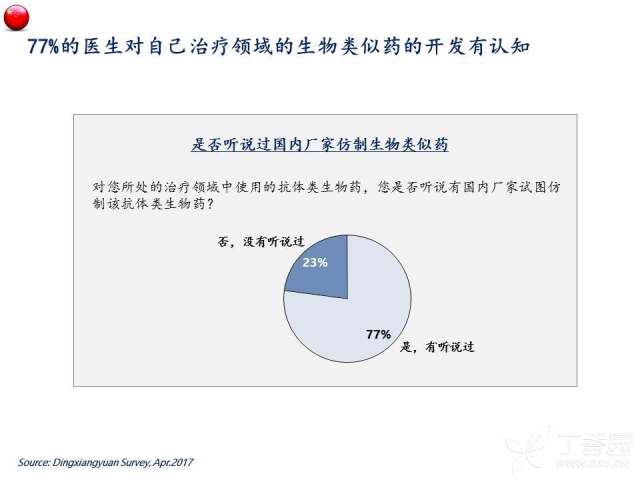
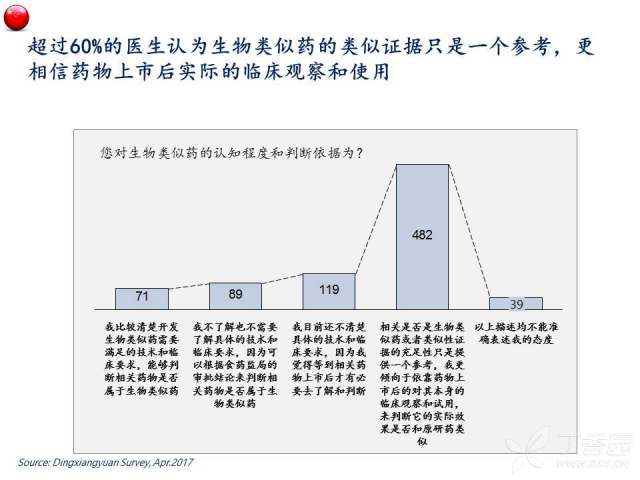
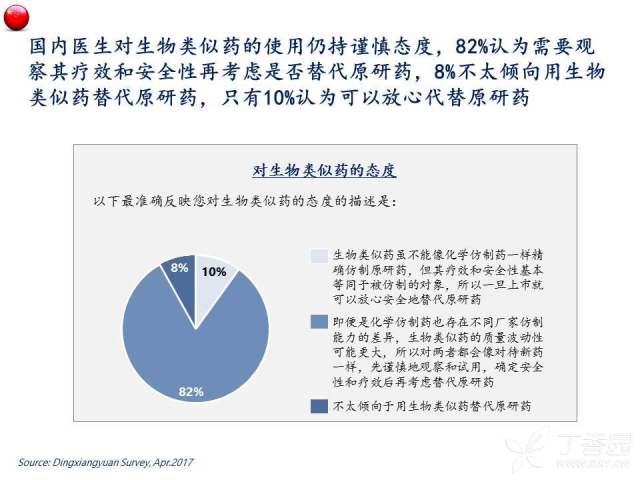
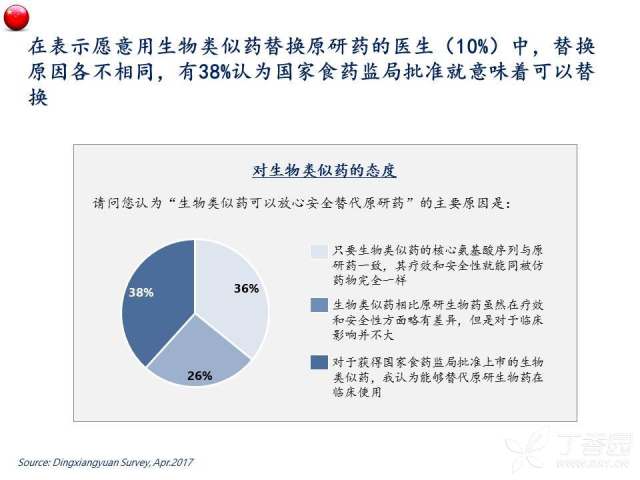
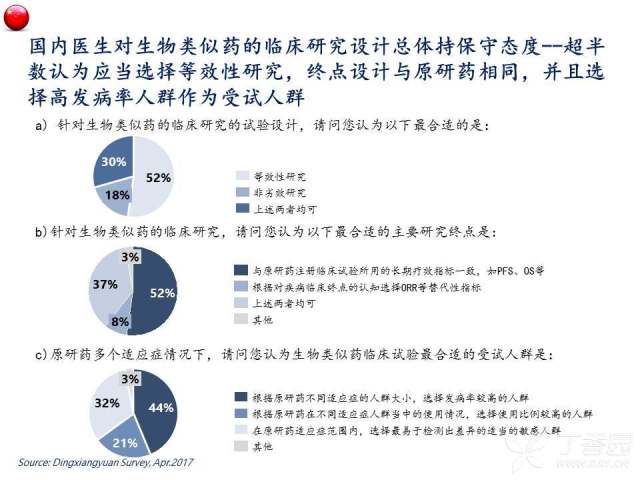
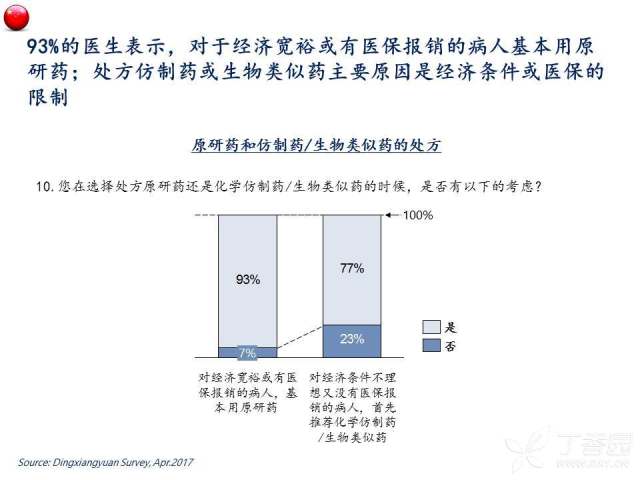
首先,伴随着中国医学界学术能力的不断进步以及对于生物类似药认知建立的持续强化,总体来看中国的肿瘤医生群体对于生物类似药的实际临床应用还是持相对审慎的态度,例如,半数以上的受访医生还是更关注生物类似药在肿瘤治疗中的实际获益,如无进展生存(PFS)和总生存(OS),以对生物类似药的临床使用效果有一个更直观直接的判断。与之相呼应的,绝大多数(>80%)医生表示在生物类似药上市后,会倾向于象对待新药一样,以谨慎的观察和试用来确定其安全性和疗效后再考虑全面替代原研药。我们认为,对于生物类似药这样的新生事物采取相对保守的态度,是医生出于对患者利益负责的一种自然的行为倾向。
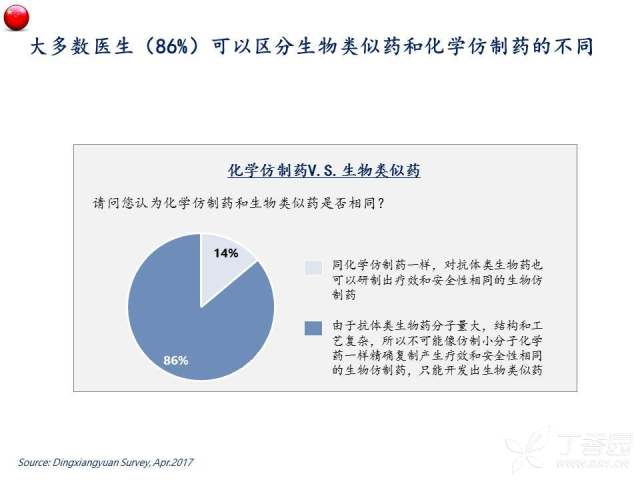
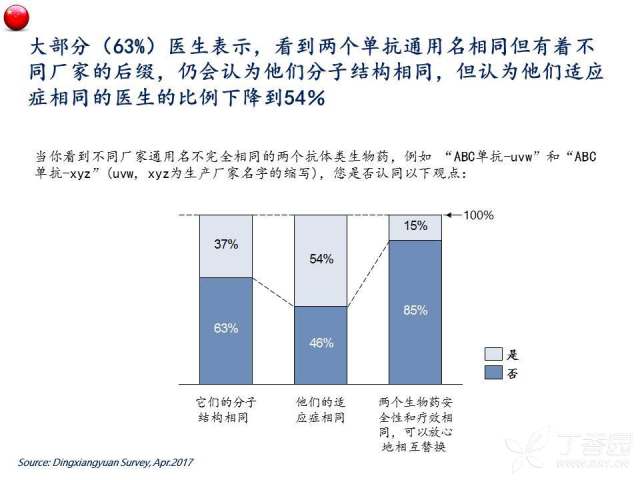
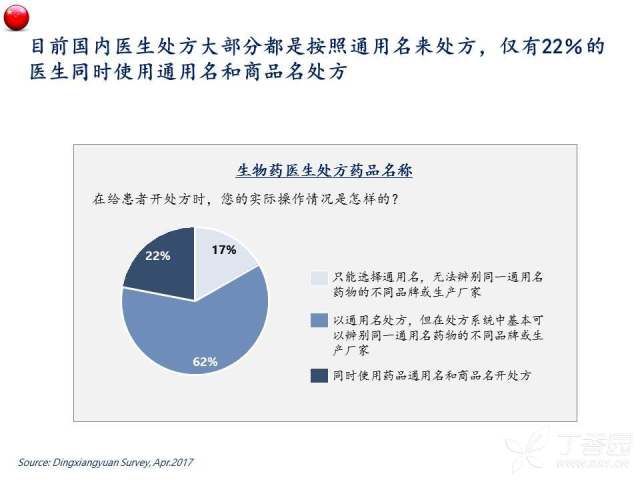
然而同时我们也观察到,医生针对生物类似药的态度也会受小分子用药经验的影响。例如: 如果原研药和生物类似药通用名完全相同,86%的医生认为他们的适应症也完全相同;如果原研药和其生物类似药的通用名通过加后缀的方式区别,可以提醒医生注意两个生物药可能存在的差异,仅有54%的医生会认为他们的适应症完全相同。“通用名相同=适应症相同”的认知可能是源于医生长期以来使用小分子仿制药的经验,但是对抗体类生物药并不适用,因为不同开发途径的生物药的适应症和用法用量都可能会不同。考虑到大多数医生(79%)在处方时仅使用通用名,如果通用名上不能区分不同的生物药,可能会给临床使用以及合理使用医保资金带来混乱。
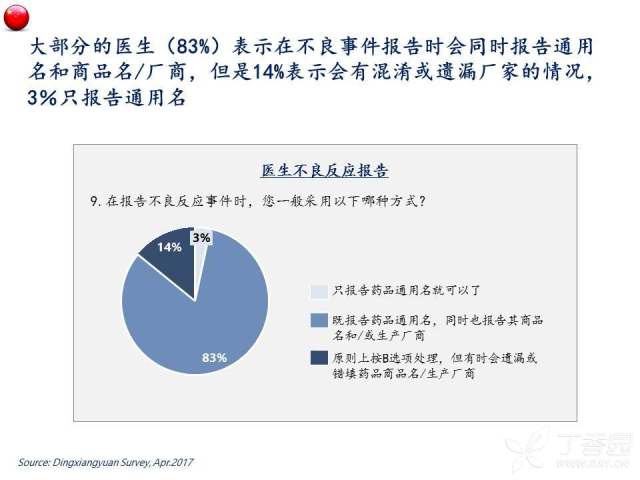
另外,考虑到生物类似药上市前有限的临床数据,上市后监管中对生物类似药不良事件的及时准确追溯对于保证患者安全尤为重要,因此我们也对医生的不良事件报告习惯进行了调查。我们注意到虽然83%的医生表示在不良事件报告时会同时报告通用名和供选填的商品名/厂商,仍有17%的医生表示会漏报、填错商品名/厂商或仅报告通用名。考虑到此次调查的是专业的群体,如果扩展到患者等非专业群体,不良事件报告的质量可能没有这么乐观。
因此我们建议,在生物类似药即将获批上市之际,政府及业界应该继续致力于塑造一个合理科学的环境,让医生能够最大程度地运用自身的医学知识和经验,对生物类似药的使用作出独立科学的判断,同时进一步完善配套政策和措施,最大程度地降低患者的风险,保障患者的利益。
报告内容