2017 年中数据盘点
· 江苏恒瑞 9 个品种登申报第一宝座
· 抗肿瘤领域为 2017 年上半年热门申报领域
· 药物上市审批趋于严格,上市药物数量下降
· 仿制药及改剂型申请(ANDA)队列大展拳脚
· 进入优先审评「快车道」药品大幅上涨
2017 年已过去一半,你该如何跑赢下半年?
Insight 数据库年中 CDE 药品审评报告梳理了 2017 年 1-6 月 CDE 药品申报和审评的数据情况,让不会骗人的数据来为你指路。
注:本文统计数据来源 Insight - China Pharma Data 数据库,除特别说明外,统计单位均为受理号,企业均按照母企业计,数据统计截止日期为 2017 年 6 月 30 日,时间以 CDE 承办时间为准。
Ø 申报受理总体情况
据 Insight-China Pharma Data 数据库统计, 2017 年 CDE 共新承办药品申请 2118 个,略低于去年成绩。
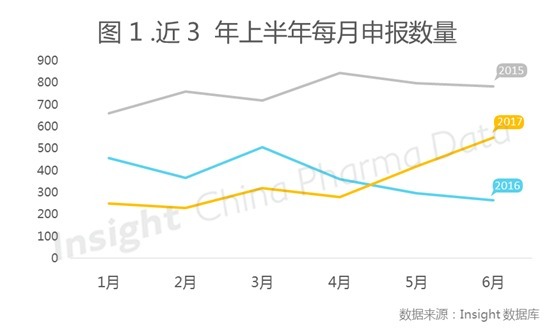
如图 1 所示,2017 年上半年每月承办数量依旧处于较低水平,但与往年从 4 月起受理号申报开始持续下跌不同的是,今年自 4 月起,申报受理量每月都有不小的涨幅,6 月受理量居上半年最高水平。该现象可能与 2016 年年底已解决药品积压受理有着密不可分的联系,该政策自 2015 年出台后,每月承办数量直线下降,如今理号数据已开始上升,接近 2015 年水平。
一、化药申报受理情况
一直以来,在每月的申报受理号中,化药都占据着极其庞大的份额,今年上半年也不例外,对比图 1 和图 2 ,化药申报数量走势与上半年申报数量走势基本重合。所以我们先来看下化药的申报受理情况。
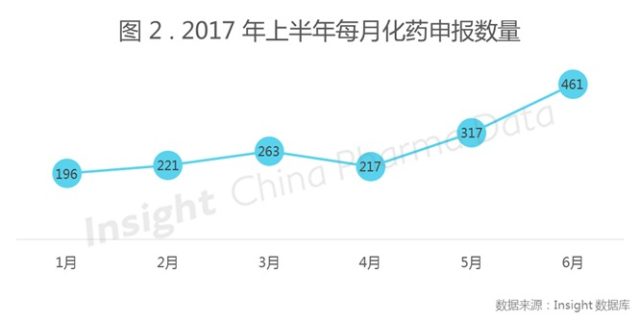
2017 年上半年受理化药共 1675 个,其中上市申请 237 个,临床申请 365 个。
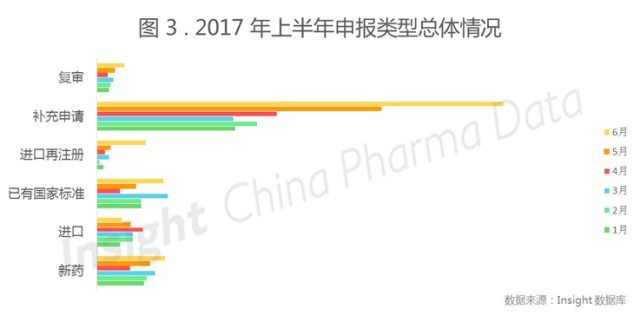
从具体申报的类别来看,补充申请和进口再注册每月数据波动幅度较大,复审和新药基本无变化。同时,值得注意的是,除 3 月外,今年上半年新药申报数量均超过仿制药数量。
江苏恒瑞 9 个品种登申报第一宝座
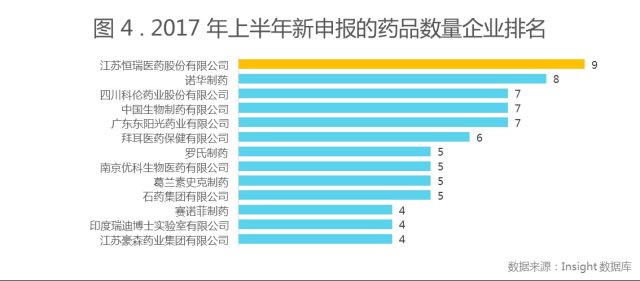
注:本图以品种为单位,按照母企业进行统计,统计数量时除去了申请类型为补充申请、复审和进口再注册的品种。
如图 4 所示,上半年申报品种数量企业排名中,江苏恒瑞以 9 个品种拔得头筹,诺华制药紧随其后。上半年申报的品种中值得一提的是,诺华与安进联合开发的口服治疗药物 CNP520 ,该药一种旨在预防不同形式的淀粉样蛋白生成的口服药物,具有预防、减缓或推迟 AD 相关症状出现的潜力。
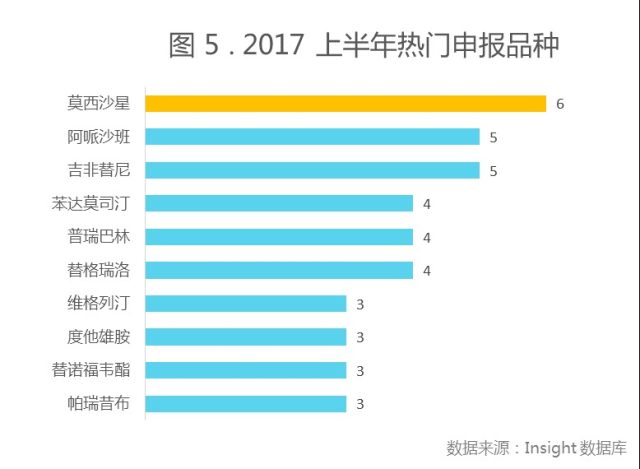
注:本图按照母企业进行统计,统计数量时除去了申请类型为补充申请、复审和进口再注册的品种。
2017 年上半年最热门的品种为莫西沙星,共有 6 家企业申报。重磅品种信息将在后文中提及。

注:创新药指国内外均未上市的药品,旧注册分类 1.1-1.6 类及新注册分类 1 类
2017 年上半年共有 181 个化药 1 类新药申报,涉及 61 个品种,从图 6 可以看出, 2017 年每月化药 1 类新药申报数量均多于 2016 年,新药队伍在不断地壮大。同时,按照注册分类来看,2017 年申报的基本全为新注册分类 1 类申报的化药,但仍存在 2 个按旧的 1.2 分类的新药。
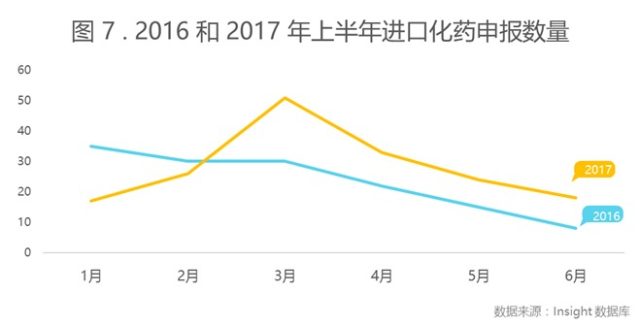
今年上半年进口药申报数量以受理号计为 169 个,如图 7 所示,相较去年,2016 年上半年进口化药承办数量持续下降,2017 年 3 月药品申报出现了一个小高峰,该月进口化药申报数量为 51 个, 3 月之后, 2017 年的进口药申报量普遍高于 2016 年,这可能与今年 3 月出台的调整进口药品注册管理有关事项的决定有关,该政策鼓励进口药申报。
注:本图以品种为单位,按照母企业进行统计。
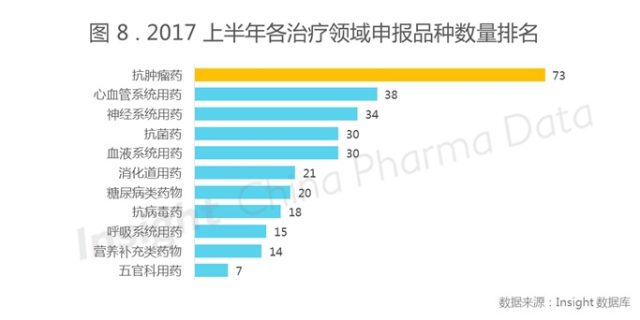
抗肿瘤领域为 2017 年上半年热门申报领域
按照 Insight 数据库即将上线的治疗领域大类筛选,制作出了今年上半年 14 个治疗领域的审结情况及批准情况。从图 8 可以看出,上半年注册超过 30 个品种的治疗领域有抗肿瘤、心血管系统、神经系统、抗菌药、血液系统用药。可见目前在中国,这 5 个大领域是申报的热点领域,其中抗肿瘤的申报最高,其次就是心血管系统领域。
二、中药及生物制品申报受理情况
根据 Insight 数据库数据统计显示,2017 年上半年申报的中药申请,以受理号计共 137 个,总数与去年上半年一致,涉及品种 22 个。2017 上半年申报的生物制品以受理号计共 287 个,涉及品种 109 个,较去年多,去年同期申报的生物制品以受理号计共 216 个,涉及品种 88 个。
Ø 总体审评审批情况
2017 年上半年,共审批受理号 3703 个,较去年同期少了一半,主要原因可能是 2016 年底药品注册申请积压情况已得到缓解。据 1-6 月的申报(图 1 )和审批情况(图 9)显示,2017 审评速度虽有减缓,但在争取实现注册申请和审评数量进出平衡。
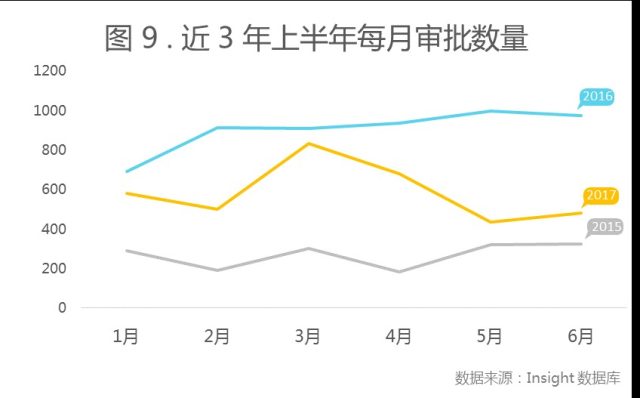
药物上市审批趋于严格,上市药物数量下降
批准上市药物按受理号统计是 42 个,相比 2016 年的 109 个,在数量上有很大滑坡,这也从侧面证明了国家局先后出台的一系列临床自查核查和药物一致性评价相关政策确实起到了作用,抬高药品上市门槛,药品质量等级也在不断的提高。
下面我们分别来看化药上市申请审批情况
一、化药审评审批情况
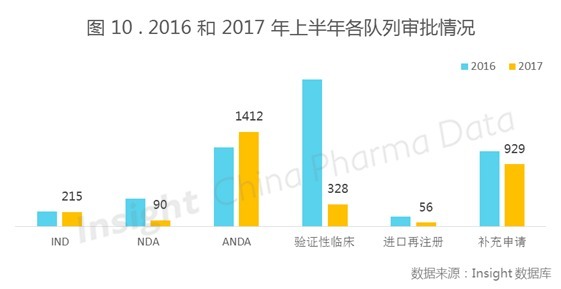
注:各审评任务序列释义:新药临床试验申请(IND),新药生产上市申请(NDA),仿制及改剂型申请(ANDA),验证性临床试验申请为申报临床的化药注册分类 3-4。
仿制药及改剂型申请(ANDA)队列大展拳脚
从图 10 可以看出,2017 年上半年化药完成审评的队列主要集中在 ANDA 和补充申请。相较去年,可能是受到早期仿制药上市一致性评价的影响,今年上半年除了 ANDA 审批数量即仿制及改剂型申请有所上升外,其他队列批准数量均呈现下降趋势,验证性临床的审批量更是锐减。在审批量方面,今年而 NDA 审批数量更是只有 90 个,后续申请批准数可能更少,可见新药上市是重重关卡,越来越困难了。
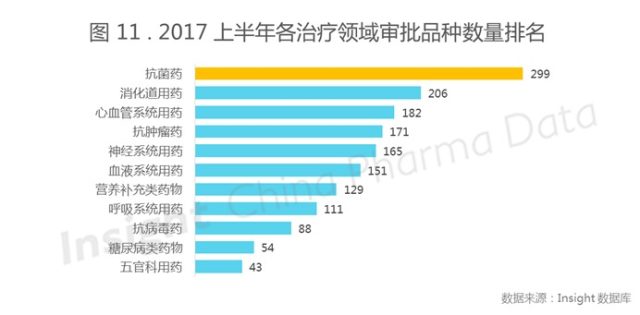
注:本图以品种为单位,按照母企业进行统计。
从图 11 可以看出,年中审批超过 150 个品种的治疗领域有抗菌药、消化道、心血管系统、抗肿瘤、神经系统和血液系统用药。可见目前在中国这 6 个大的领域是审评审批的热点领域,与申报热门的 5 大治疗领域重合。
二、优先审评审批情况
进入优先审评「快车道」药品大幅上涨
2016 年 2 月发布的《解决药品注册申请积压实行优先审评审批的意见》,明确了部分药品可以获得优先审评审批资格。2016 年上半年仅儿童用药 2 个,病毒性肝炎 4 个,但今年获得优先审评审批资格的药品数大幅增加。
据 Insight 数据库搜索数据显示:其中因具有明显临床价值获得优先审评审批资格的药品,有 5 个国外已上市同步申请国内上市的仿制药,1 个在欧美同步申请,2 个首仿品种,2 个Ⅱ/Ⅲ期临床试验申请 ,20 个优先审评审批,21 个创新药;而因为防治特有疾病且具有明显临床优势的药品注册申请的而获得先审评审批资格的,有 1 个病毒性肝炎,5 个恶性肿瘤,8 个抗丙肝药物,1 个乙型肝炎治疗药物,7 个艾滋病治疗药物。
Ø 重磅品种
替诺福韦
富马酸替诺福韦二吡呋酯,简称替诺福韦,该药是由 Gilead 开发, 08 年以艾滋病治疗药物进入中国,13 年在国内获批乙肝适应症,因是目前最前沿、最优效、最安全的抗乙肝病毒药品,抢仿大战非常激烈,有安徽贝克、正大天晴、齐鲁制药、广生堂等多个抗病毒领域的大牌企业参与其中,据 Insight 数据库搜索显示,除进口品外,国内已有 3 个仿制品上市,分别来自福建广生堂药业、成都倍特和齐鲁制药。
奥希替尼
2017 年 3 月,奥希替尼(泰瑞沙®)获批在中国上市。该药是中国首个获批的第三代肺癌靶向药物,用于治疗 EGFR T790M 突变阳性的局部晚期或转移性非小细胞肺癌的靶向药物,它打破了中国肺癌患者在经过 EGFR-TKI 治疗耐药后无药可医的瓶颈,是肺癌靶向治疗的重大进展。
阿达木单抗
2017 年 5 月,艾伯维公司旗下产品阿达木单抗注射液(Adalimumab)-修美乐®正式获批用于治疗成年中重度慢性斑块状银屑病。继类风湿性关节炎和强直性脊柱炎之后,这是阿达木单抗注射液在中国获批的第三个适应症。
人乳头瘤病毒疫苗(四价 HPV 疫苗)
2017 年 5 月,默沙东四价 HPV 疫苗佳达修(Gardasil)正式获批上市,即将在中国内地上市,该药为用于预防宫颈癌的疫苗,对宫颈癌的预防率可达 90%。
达拉他韦 (DCV)/阿舒瑞韦(ASV)
2017 年 5 月,达拉他韦和阿舒瑞韦批准进口上市,用于治疗成人基因 1b 型慢性丙型肝炎(非肝硬化或代偿期肝硬化)的联合治疗。此方案是一种不含有干扰素给药的完全口服给药方案,适用于治疗基因 1b 型慢性丙型肝炎(CHC)代偿性肝病成人患者,包括对单独应用干扰素治疗或干扰素联合应用利巴韦林治疗不适合或不耐受的患者。
雷沙吉兰
2017 年 5 月,雷沙吉兰批准进口,该药是丹麦灵北公司和以色列梯瓦公司共同开发的第二代单胺氧化酶抑制剂,2006 年 5 月 FDA 批准其在美国上市,商品名 Azilect。雷沙吉兰比第一代单胺氧化酶抑制剂司来吉兰功效强 5~10 倍,副作用小且具有一定的神经保护作用,是全球帕金森市场的领军品种。目前,齐鲁制药、北京德众万全、常州四药、辅仁药业、四川奥邦药业、重庆华森、上海中西制药等多家企业获得临床批文。

扫码关注Insight 微信公众号,点击「我要试用」,即可在微信上查询数据,还能获得医药情报数据管理专业平台的 VIP 用户试用权哦。
